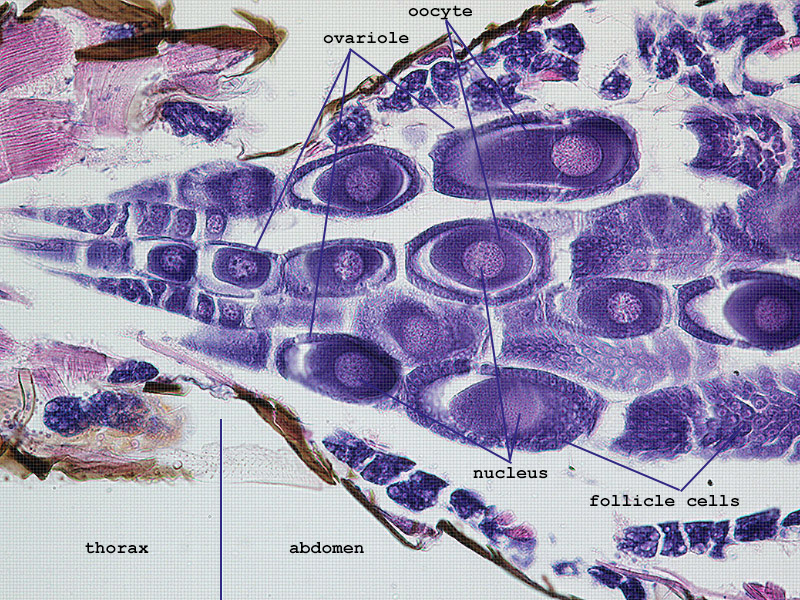
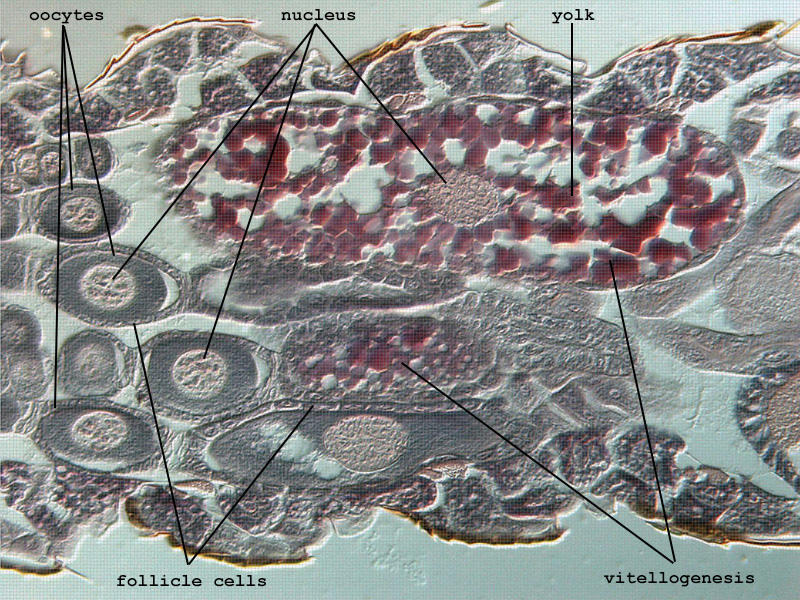
Die Entwicklung der Eizellen (Oozyten) erfolgt in paarigen Ovarien, die jeweils aus 4 sekundär panoistischen Ovariolen bestehen (Fig. 1). Innerhalb der Vitellarien sind die Eizellen seriell angeordnet und nehmen in Richtung des Ovipositors stark an Größe zu. Dabei flachen sich die Follikelzellen ab und einzelne Komponenten der Eizelle ändern während der Vitellogenese sehr deutlich ihre Affinität gegenüber den eingesetzten Farbstoffen (Fig. 2). In dieser Phase zeigen die Zellkerne der Oozyten teilweise an Lampenbürstenchromosomen erinnernde Strukturen (Fig. 3).
<!– wp:shortcode –>
<!– /wp:shortcode –>
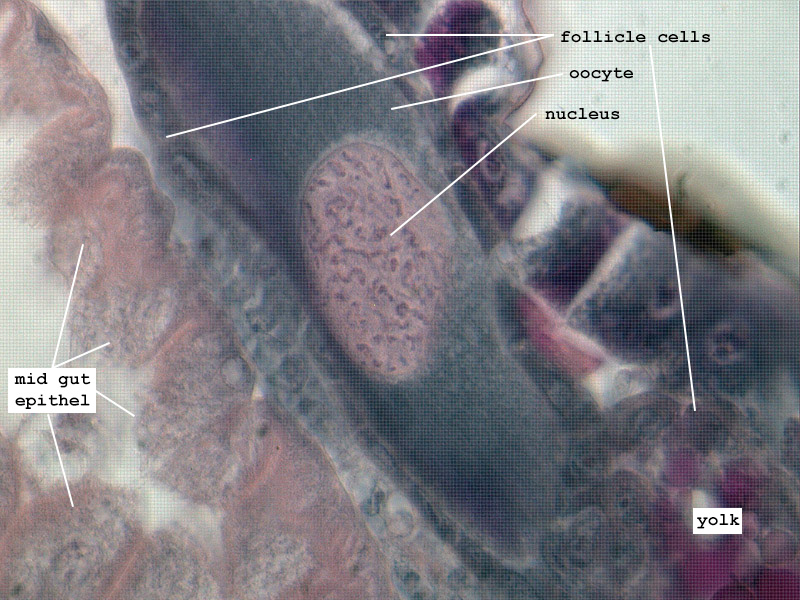
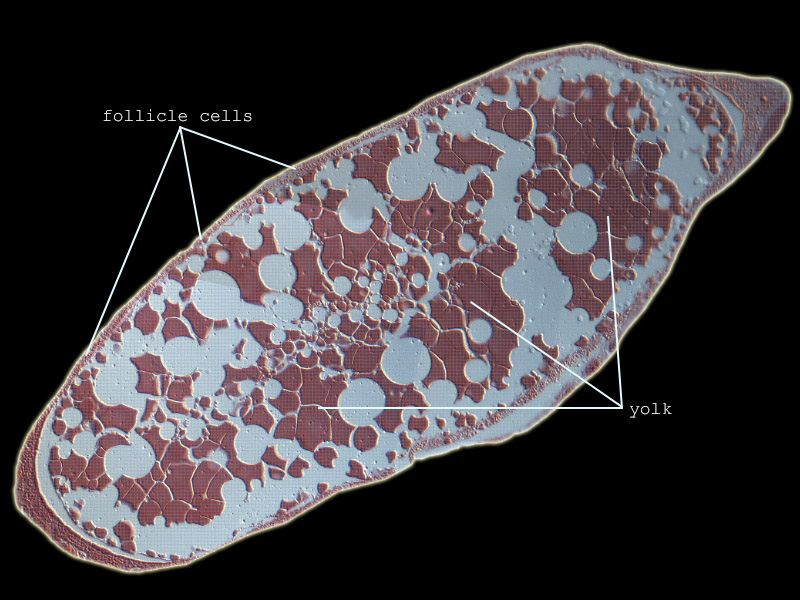
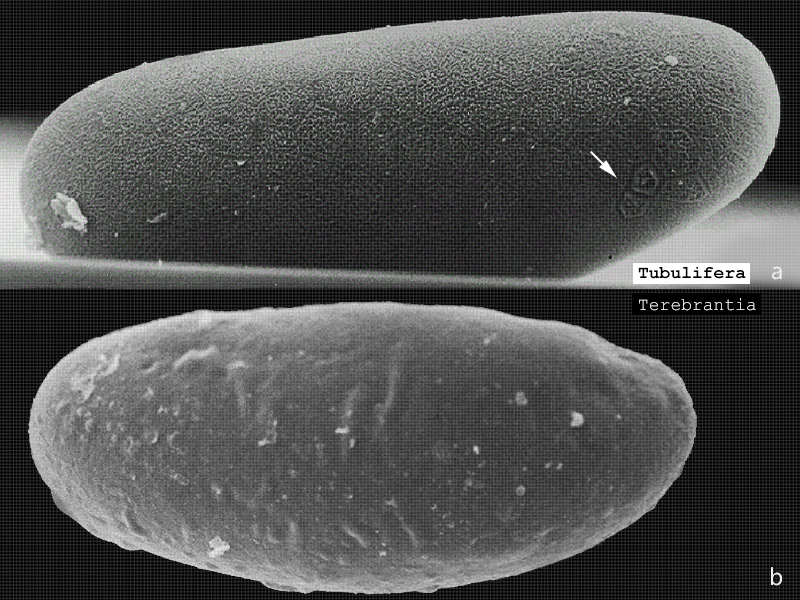
Nach der Vitellogenese liegen die Kernstrukturen konzentriert in der Peripherie des an Dotter reichen Ooplasmas, die Follikelzellen sind weiter abgeflacht und die sich formierende Chorion-Schicht zu erkennen (Fig. 4). Das Exochorion der Eier der Unterordnung Tubulifera ist durch penta- und hexagonale Chitin-Skulpturen versteift. Diese Eissysteme werden auf dem Substrat befestigt und durch diese kompakten Verstrebungen stärker geschützt. Demgegenüber nutzen die mit einem Ovipositor ausgestatteten Arten der Terebrantia diesen Legeapparat, um die Eier direkt unter die Epidermis des Pflanzengewebes geschützt abzulegen. Die glatte Oberfläche des Exochorions unterstützt diese Funktion hervorragend (Fig. 5). Ein Operculum schließt das Ei in Höhe der pflanzlichen Cuticula ab und wird oftmals noch durch Sekretabgabe des Weibchens geschützt. Ein weiterer Schutz entsteht durch die Suberinisierung der äußeren pflanzlichen Hülle um das Exochorion des Eisystems (MORITZ 2006). Die Eier der Thysanopteren sind ellipsoid bzw. reniform und im Vergleich zum Abdomen der Weibchen auffallend groß (Aeolothrips intermedius: ca. 430×175 µm (MORITZ 1982), Caudothrips buffai 590×230 µm (BOURNIER 1966), Limothrips denticornis 375×112 µm (HOLTMANN 1962), Hercinothrips femoralis 250×210 µm (WHITE 1916), Haplothrips (Haplothrips) verbasci 420×150 µm HEMING 1979)). Bei wenigen Arten ist auch Ovoviviparie zu finden, wie z.B. bei Gynaikothrips ficorum (Fig. 6) (MORITZ 2006). JOHN beschrieb bereits 1922 bei Megathrips lativentris Weibchen, deren Ovariolen zahlreiche Eier mit bereits sich entwickelnden Embryonen enthielten und Crespi (1989) erkannte bei Elaphrothrips tuberculatus, dass die männlichen Nachkommen bereits in den Weibchen durch fakultative Viviparie entstehen.
.
Literatur:
Bournier, A. (1966). L’embryogenese de Caudothrips buffai KARNY (Thys., Tubulifera). Ann. Soc. Entomol. Paris 2: 415-435.
Crespi, B.J. (1989). Facultative viviparity in a thrips. Nature 337 (26): 357-358.
Heming, B. S. (1970). Postembryonic development of the female reproductive system in Frankliniella fusca (Thripidae) and Haplothrips verbasci (Phlaeothripidae) (Thysanoptera). Miscellaneous Publications of the Entomological Society of America 7(2): 199-234.
Holtmann, H. (1962). Untersuchungen zur Biologie der Getreide-Thysanopteren (Teil 1). Z. angew. Entomol. 51: 1-41.
John, O. (1922). On the development and life history of Megathrips lativentris Heeg. Bull. Station Régionale Protectrice des Plantes. Pétrograd, 3: 108-122.
Moritz, G. (1982). Zur Morphologie und Anatomie des Fransenflüglers Aeolothrips intermedius Bagnall, 1934 (Aeolothripidae, Thysanoptera, Insecta) 3. Mitteilung: Das Abdomen. Zool Jb. Anatomie 108: 293-340.
Moritz, G. (2006). Thripse. Hohenwarsleben, Die Neue Brehm-Bücherei Bd. 663, Westarp Wissenschaften, 384pp.
White, W. H. (1916). The sugar-beet thrips. Bull. U. S. Dept. Agriculture 421: 1-12.